Newsletter
Hier finden Sie Anregungen und Materialien für die Vermittlung lebenswissenschaftlicher Themen im Unterricht. Von A wie Allergie bis Z wie Zelle.
Q&A: Fragen und Antworten zu SARS-CoV-2 und COVID-19
Ein Isolat von SARS-CoV-2 unter dem Elektronenmikroskop, Bild: Tobias Hoffmann, Robert Koch-Institut (RKI), 2020.
Gemeinsam mit der Impfstoffexpertin Christina Nicolodi und dem Virologen Tim Skern beantwortet Open Science viele Fragen rund um SARS-CoV-2 und COVID-19.
Der umfassende Fragen- und Antwortenkatalog behandelt allgemeine Themen zum Virus und der Pandemie ebenso wie spezielle Fragestellungen mit dem Wissensstand von September 2022.
Das Q&A-Dokument steht online zum Lesen sowie als Pdf im Downloadbereich dieses Artikels zur Verfügung, Nutzungsbedingungen: CC BY-NC-ND 3.0 AT.
Das Virus und die Pandemie
Allgemeines
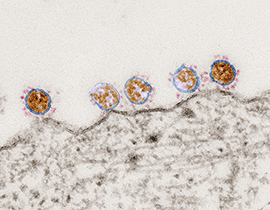
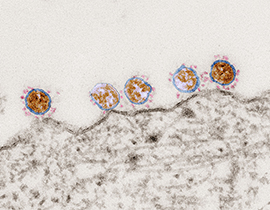
- Kann man Corona sehen?
Viren sind kleine Partikel, die mit freiem Auge nicht sichtbar sind. Sie sind so klein, dass man sie selbst mit einem gewöhnlichen Lichtmikroskop nicht sehen kann. Man benötigt spezielle Mikroskope wie z.B. ein Elektronenmikroskop, um sie sichtbar zu machen. Dieses Elektronenmikroskop-Bild zeigt beispielsweise mehrere runde Coronaviren auf der Oberfläche einer Zelle.
- Wie sequenziert man das Genom eines Virus?
Diese Frage wird in unserem Artikel „Sequenzieren – So entdeckt und unterscheidet man Coronavirus-Varianten“ beantwortet.
- Was ist der Unterschied zwischen einer Epidemie, einer Endemie und einer Pandemie?
Von einer Epidemie spricht man, wenn sich der Ausbruch auf eine bestimmte Region, wie beispielsweise einen Kontinent, beschränkt. Eine Endemie eine in einer Region heimische Krankheit, an der ein größerer Teil der Bevölkerung regelmäßig erkrankt. Es kommt also zu wiederkehrenden Ausbrüchen. Bei einer Pandemie hingegen kommt es – wie aktuell beim neuen Coronavirus SARS-CoV-2 – zu einem weltweiten Ausbruch der Infektion.
- In der Geschichte der Menschheit gab es bereits zahlreiche Pandemien, bei denen teilweise Millionen Tote zu beklagen waren. Doch Viren wollen ihre Wirte eigentlich gar nicht töten. Wie entstehen dann Pandemien?
Viren wie Ebola oder SARS-CoV-2 haben einen Wirt, in dessen Organismus sie sich ausbreiten können, ohne ihn krank zu machen. Diese Viren haben sich an den jeweiligen Wirt angepasst und vervielfältigen sich in seinem Organismus, ohne ihm zu schaden. Für Ebola oder SARS-CoV-2-Viren wird angenommen, dass sie sich so ursprünglich in mehreren Arten von Fledermäusen ausgebreitet haben. Krankheiten können aber auch von Tieren auf Menschen - oder umgekehrt - übertragen werden, man spricht von so genannten Zoonosen. Man nimmt an, dass das auch bei Ebola und SARS-CoV-2 der Fall war. Wenn diese Viren dann den Menschen infizieren, sind sie nicht an diesen angepasst und schaden ihm bei der Ausbreitung in seinem Organismus. Im Fall von Ebola kommt es immer zu einer ernsten, oft tödlichen Krankheit. Bei SARS-CoV-2 hängt der Schweregrad der Erkrankung vom Alter und dem Gesundheitsstatus der infizierten Person ab.
- Woher kommt SARS-CoV-2? Wie sieht das die Fachwelt heute?
Coronaviren an sich gibt es schon länger, die ersten Vertreter dieser Virus-Familie wurden bereits Mitte der 1960er-Jahre beschrieben. SARS-CoV hat bereits in den Jahren 2002/2003 eine Pandemie ausgelöst, und die MERS-CoV-Epidemie begann 2012.
SARS-CoV-2 ist durch die Rekombination von zwei oder mehreren Coronaviren entstanden, vermutlich in Fledermäusen in China. Der unmittelbare Vorgänger von SARS-CoV-2 wurde noch nicht gefunden und wird es vermutlich auch nie werden. Die aktuell verfügbaren Hinweise deuten jedoch auf die indirekte Übertragung eines Fledermaus-Virus auf Menschen in China hin. Aktuelle Studien weisen darauf hin, dass es zu einem sogenannten Superspreading auf dem Huanan-Markt in Wuhan gekommen sein könnte.
- Was sind die wichtigsten Fakten zu SARS-CoV-2, die man kennen sollte?
SARS-CoV-2 zählt zur Familie der Coronaviren, welche regelmäßig in den Wintermonaten auftreten und die meisten harmlos sind. Gegen die harmlosen Coronaviren gibt es keine Impfung, gegen SARS CoV-2 schon.
Generell sollte man wissen, wie man die Wahrscheinlichkeit einer Infektion minimieren kann: Gut gelüftete Räume, Masken tragen in geschlossenen Räumen, physisches Abstandhalten – das sind die wichtigsten Vorkehrungen, die das Infektionsrisiko deutlich senken können. Das trifft vor allem auf die Risikogruppen wie Über-60-Jährige, Übergewichtige und Diabetiker zu.
Seit 2021 hat sich die Impfung als exzellente Methode erwiesen, um die Schwere von SARS-CoV-2-Infektionen zu reduzieren. Doch die oben erwähnten Maßnahmen sind neben der Impfung noch immer wichtig, um die Ansteckung sowie die Möglichkeit des Auftretens neuer Varianten gering zu halten.
- Momentan gibt es eine große Vielzahl an Fake news im wissenschaftlichen/politischen Bereich. Wie kann man erkennen, ob es sich um richtige Informationen oder eben Falschinformationen handelt? Welche Quellen können Sie für Menschen empfehlen, für die kein spezielles Wissen notwendig ist?
Diese Thematik wird in unserem „Leitfaden zur Internetrecherche“ aufgegriffen.
Mutationen und Varianten
- Wie entstehen Mutationen bei Viren, und was unterscheidet sie von Varianten?
Diese Frage wird in unserem Video „SARS-CoV-2: Mutationen und Varianten des Coronavirus“ beantwortet.
- Das Coronavirus mutiert schnell, und wir haben schon das Auftauchen mehrerer neuer Virusvarianten miterlebt. Was hat das für Auswirkungen?
Alle Viren mutieren. Die Frage ist, ob sich Viren dabei so weiterentwickeln, dass sie neue Eigenschaften annehmen. Die Ereignisse der letzten Jahre haben gezeigt, dass es Wellen neuer Varianten mit neuen Eigenschaften gibt – wie etwa höhere Übertragung (z.B. SARS CoV-2 Varianten Delta oder Omikron), höhere Virulenz (z. B. Delta) und niedrigere Virulenz (Omikron). Obwohl die Übertragungsrate von Omikron sehr hoch zu sein scheint, gibt es noch immer die Möglichkeit, dass eine Variante mit einer noch höheren Übertragungsrate entsteht. Hohe Infektionszahlen in vielen Ländern können Nährboden für die Entstehung neuer Varianten sein.
- Gibt es eine Variante von SARS-CoV-2, bei der kein derzeit angebotener Impfstoff wirkt?
Nein, zurzeit gibt es so einen Stamm nicht.
- Können durch das Impfen in der Pandemie erst recht noch viel gefährlichere Mutationen entstehen?
Varianten können nur auftauchen, wenn das Virus sich vermehrt. Impfstoffe reduzieren die Vermehrung des Virus und tragen dazu bei, dass weniger Varianten entstehen. Sie verringern das Risiko, dass neue, pathogene Varianten entstehen. Bis jetzt hat kein Impfstoff dazu geführt, dass irgendein Virus gefährlicher geworden wäre.
-
Bei neuen Virus-Varianten besteht die Gefahr, dass existierende Impfstoffe eingeschränkte Wirksamkeit zeigen. Wie leicht ist es, die aktuellen Impfstoffe an neue Mutationen und Varianten anzupassen?
Im Fall von mRNA-Impfstoffen ist diese Anpassung der mRNA-Sequenz relativ einfach und rasch umzusetzen. Bei anderen Impfstoffen, wie z. B. Vektorimpfstoffen und Proteinimpfstoffen ist eine Änderung etwas aufwendiger. Bei einer Anpassung von Vektorenimpfstoffen oder inaktivierten Ganzvirus-Impfstoffen müssen die Virus-Varianten von neuem gezüchtet werden.
Integration der Virus-Erbinformation ins menschliche Genom
- Wie hoch ist die Gefahr, dass es bei Impfungen mit mRNA durch den Prozess der reversen Transkription – eventuell via Retroviren – unerwünschte Veränderungen in der DNA (Erbinformation) geben könnte? Und dass diese erst nach längerer Zeit oder bei den Kindern geimpfter Eltern auftreten?
Diese Gefahr ist äußerst gering, da das Coronavirus kein Retrovirus ist und da es kaum Reverse Transkriptase in menschlichen Zellen gibt. Und damit Kinder von geimpften Eltern eine solche Veränderung überhaupt vererbt bekommen, müsste die potenzielle Fremd-DNA außerdem in die Keimbahnzellen kommen, auch äußerst unwahrscheinlich.
- Wie kann man sichergehen, dass die DNA der Vektorimpfstoffe nicht ins menschliche Erbgut integriert wird?
Wir wissen, dass Adenoviren sich mit sehr niedriger Wahrscheinlichkeit integrieren. Weiters gibt es Vektorimpfstoffe ja schon länger, und in den letzten 30 Jahren wurden viele Tests gemacht, die zeigen, dass die Vektoren sich nicht integrieren.
- Kann SARS-CoV-2 nach einer Infektion im Körper verweilen?
Ja. Eine groß angelegte Studie hat gezeigt, dass Erkrankte das Virus im Durchschnitt etwa einen Monat lang ausscheiden. Die größte Persistenz (Bestehenbleiben) von SARS-CoV-2 zeigte sich im respiratorischen Trakt, beschränkte sich aber nicht darauf: Das Virus konnte auch im Appendix, Augen, Herz und Gehirn nachgewiesen werden. In Einzelfällen verblieb SARS-CoV-2 mehrere hundert Tage im Körper. Noch ist nicht bekannt, wie das möglich ist, aber die Dauer der Persistenz ist sicher abhängig vom Immunsystem des/der Einzelnen.
Impfstoffe gegen COVID-19/ SARS-CoV-2
Verschiedene Impfstoff-Typen
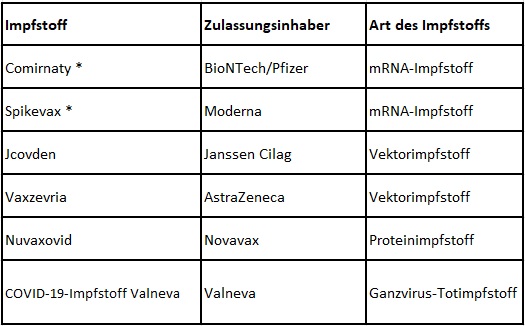
- Welche Impfstoffe sind aktuell in Europa gegen COVID-19/SARS-CoV-2 zugelassen?
Zurzeit sind in Europa insgesamt sechs Corona-Impfstoffe zugelassen: Die mRNA-Impfstoffe Comirnaty (BioNTech/Pfizer) und Spikevax (Moderna), die Vektorimpfstoffe Jcovden (Janssen) und Vaxzevria (AstraZeneca) sowie der Proteinimpfstoff Nuvaxovid (Novavax) und der Ganzvirus-COVID-19-Impfstoff Valneva (Valneva). Comirnaty und Spikevax sind auch als bivalente Impfstoffe verfügbar – siehe auch nächste Frage.
- Was versteht man unter bivalenten Corona-Impfstoffen, und welche sind bei uns zugelassen?
Bei bivalenten Covid-19-Impfstoffen handelt es sich um angepasste Versionen der ursprünglichen Impfstoffe, die zusätzlich gegen neue Varianten gerichtet sind. Folgende bivalente Impfstoffe sind für Personen ab 12 Jahren zugelassen und in Österreich teilweise auch schon verfügbar: Comirnaty Original/Omicron BA.1, Spikevax Bivalent Original/Omicron BA.1 und Comirnaty Original/Omicron BA.4-5.
mRNA- und Vektorimpfstoffe (oft auch fälschlich als „genbasierte Impfstoffe“ bezeichnet)
- Wie funktionieren mRNA- und Vektorimpfstoffe im Vergleich?
Diese Frage beantwortet unser Video „SARS-CoV-2: Corona-Impfstoffe im Vergleich (mRNA und Vektor)“.
- Was sind die Vor- bzw. Nachteile von mRNA-Impfstoffen im Vergleich zu Vektorimpfstoffen?
Die Vorteile von mRNA-Impfstoffen: Sie sind schneller herzustellen, sind gegen SARS CoV-2 sehr wirksam, sehr leicht zu modifizieren, um gegen Varianten zu schützen, und es handelt sich um kein vermehrungsfähiges Virus. Die Nachteile: mRNA-Impfstoffe müssen sehr kalt gelagert und drei Mal gespritzt werden, um den besten Schutz zu bekommen und Antikörper werden nur gegen ein bestimmtes Protein gebildet. Wie lange der Schutz hält, richtet sich unter anderem nach der auftretenden Virus-Variante, hängt aber auch von der geimpften Person ab (Alter, Gesundheitszustand, vorangegangene Immunisierungen/Infektionen, …).
- Verwenden die mRNA-Impfstoffe von Moderna und BioNTech/Pfizer die gleichen mRNA-Sequenzen?
Fast, es gibt nur kleine Unterschiede in der Sequenz der mRNA. Die Technologie ist ähnlich.
- Seit wann gibt es Vektorimpfstoffe? Gab es Vektorimpfstoffe schon vor den SARS-CoV-2 Impfstoffen?
Vektorimpfstoffe wurden bereits gegen MERS eingesetzt und wurden auch in den letzten Jahren im größeren Stil gegen Ebola in DRC/Kongo verwendet. Also ja, es gab sie auch schon vor der Corona-Pandemie.
- Handelt es sich bei Vektorimpfstoffen um RNA- oder DNA-Viren (Adenoviren)?
Für die beiden Vektorimpfstoffe von AstraZeneca und Janssen Cilag International / Johnson & Johnson werden DNA-Viren als Vektoren, also als Transportvehikel, verwendet. Es handelt sich dabei in beiden Fällen um ein Virus aus der Familie der Adenoviren (Erkältungsviren)– bei Janssen ist das ein humanes Adenovirus, bei Vaxzevria ein Schimpansen-Adenovirus. Diese so genannten adenoviralen Vektoren wurden so modifiziert, dass sie in Menschen nicht mehr vermehrungsfähig sind.
- Wie stellt man sicher, dass sich die verwendeten Adenoviren in den Vektorimpfstoffen nicht mehr vermehren können?
Adenovirus-basierende Vektorimpfstoffe wie Vaxzevria (AstraZeneca) oder Jcovden (Janssen) müssen gesetzlich in ihrer Erbinformation so verändert werden, dass sie nicht mehr pathogen (gefährlich) sein können. Dafür werden bestimmte Gene der Adenoviren entfernt, die für deren Vermehrung essenziell sind. Würde man diese Gene nicht entfernen, könnte das Virus sich vermehren und Krankheiten wie Schnupfen oder Durchfall verursachen und durch Kontakt weitere Personen infizieren.
Andere Impfstoffe (Ganzvirus- und Proteinimpfstoffe) gegen COVID-19/SARS-CoV-2
- Welche anderen Impfstoffe gegen COVID-19 sind in Europa bereits zugelassen?
Aktuell (Stand 09/2022) sind in Europa der Proteinimpfstoff Nuvaxovid (Novavax) und der Ganzvirus-COVID-19-Impfstoff Valneva (Valneva) zugelassen.
- Wie funktionieren diese Impfstoffe im Vergleich zu mRNA- und Vektorimpfstoffen?
Totimpfstoffe unterscheiden sich grundlegend von mRNA- und Vektorimpfstoffen (siehe auch unser Video „Totimpfstoffe gegen SARS-CoV-2: Ganzvirus- und Proteinimpfstoffe“).
Bei mRNA- und Vektorimpfstoffen wird die genetische Information – also der Bauplan – für das virale Spike-Protein in die menschlichen Zellen eingeschleust. Dieses Oberflächen-Protein des Virus wird in weiterer Folge von der zelleigenen Maschinerie des Menschen hergestellt. Wie mRNA- und Vektorimpfstoffe im Detail funktionieren, erklären wir in diesem Video.
Totimpfstoffe funktionieren anders: Bei inaktivierten Ganzvirusimpfstoffen – den „klassischen“ Totimpfstoffen – wird das gesamte Virus für die Impfung verwendet. Dieses wird allerdings zuvor inaktiviert und unschädlich gemacht, damit es sich nicht mehr vermehren kann und keine Krankheit auslöst. Proteinimpfstoffe enthalten nur einzelne Proteine des Erregers, im Fall des Coronavirus das Spike-Protein.
- Warum beinhalten Totimpfstoffe Wirkverstärker (Adjuvantien)?
Weder inaktivierte ganze Viren noch Proteine allein lösen im Körper eine ausreichende Immunreaktion aus. Daher müssen sie mit Wirkverstärkern, sogenannten Adjuvantien, verabreicht werden. Diese Moleküle sind für die Bildung von Antikörpern wichtig, denn sie aktivieren das Immunsystem und verbessern die Immunantwort.
Bei den aktuell verfügbaren inaktivierten Ganzvirus-Impfstoffen gegen Corona werden meist Aluminiumsalze als Adjuvantien verwendet. Diese kommen schon lange standardmäßig für verschiedenste Impfstoffe zum Einsatz und sind in geringen Konzentrationen unbedenklich.
Der erste in Europa verfügbare Proteinimpfstoff von Novavax verwendet als Adjuvans ein Saponin – ein Extrakt des Seifenrindenbaums – mit der Bezeichnung Matrix-M. Zusammen mit Protein-Nanopartikeln vermittelt Matrix-M den Spike-Proteinen eine besondere Architektur: Diese gruppieren sich in Form eines Kranzes darum herum und bilden eine virusähnliche Struktur.
Zulassung von Impfstoffen
- Warum dauern Entwicklung und Zulassung von Impfstoffen im Normalfall zehn bis fünfzehn Jahre?
Das hat viele Gründe: Die Grundlagenforschung braucht Zeit, und es werden Studien durchgeführt, um den idealen "Kandidaten" für die Entwicklung zu ermitteln. Das kann schon mehrere Jahre in Anspruch nehmen. Dann werden die präklinischen Studien schrittweise absolviert, und erst danach erfolgen noch die klinischen Studien. Der Zulassungsprozess selbst dauert im Schnitt auch noch einmal 18 Monate.
Eine klinische Studie braucht im Schnitt von der Vorbereitung bis zum Abschluss etwa zwei Jahre, der Genehmigungsprozess bei Impfstoffen in etwa 6 - 12 Monate. Werden neue Daten generiert, ermittelt man stets die Rentabilität u.v.m. Diese und noch mehr Faktoren beeinflussen die Dauer der Entwicklung.
- Viele kritisieren immer wieder den schnellen Fortschritt zur Impfung gegen COVID-19/SARS-CoV-2 und argumentieren, dass die Zulassung für einem Impfstoff länger dauern müsse (10 bis 15 Jahre). Was kann man da antworten?
Es wurde im Fall von SARS-CoV-2 erlaubt, einzelne Studienphasen zu kombinieren. Außerdem durften präklinische Studien, die früher vor den klinischen Studien durchgeführt werden mussten, parallel zu den klinischen Studien gemacht werden. Man spricht von einer „Teleskopierung der Entwicklung“. Weiters wurden bürokratische Hürden abgebaut – z.B. Begutachtungsfristen verkürzt oder eine schrittweise Vorlage von Unterlagen ermöglicht. Letztendlich mussten für die Corona-Impfstoffe aber die gleichen Daten vorgelegt werden, die generell für die Entwicklung und Zulassung von Impfstoffen notwendig sind. Hier gibt es keine Einschränkungen.
- Forschung und Entwicklung bei der mRNA-Technik laufen ja mittlerweile schon seit rund 20 Jahren. Warum wurde diese Technik nicht schon früher bei Impfungen angewandt und im Zuge von SARS-CoV-2 doch (notfall-)zugelassen?
Erst nach Jahren der Forschung und Entwicklung hat man festgestellt, dass mRNA für Impfstoffe in Lipid-Nanopartikel (LNP) verpackt werden muss, damit sie die Zellen erreicht. mRNA-Impfstoffe gegen z.B. HIV wurden in klinischen Studien erprobt, funktionierten aber nicht. Bei HIV ist es aufgrund seiner Eigenschaften schwierig, Impfstoffe zu generieren, bekannterweise hat bei HIV bisher überhaupt keine Methode funktioniert. Außerdem fehlten vor der Corona-Pandemie vielen Unternehmen die finanziellen Mittel für eine rasche Entwicklung von mRNA-Impfstoffen. Man kann von einem Riesenglück sprechen, dass Antikörper, die im Zuge einer Corona-Impfung gegen das Spike-Protein von SARS-CoV-2 gebildet werden, das Virus inaktivieren. Diese Tatsache machte es überhaupt denkbar, dass die Synthese dieses Proteins von der mRNA Schutz bieten könnte. Das war vorher nicht klar. Im Gegensatz inaktivieren die Antikörper gegen HIV das Virus nicht. Deswegen sind alle Versuche, einen Impfstoff gegen HIV zu produzieren, gescheitert.
Andere Strategien für Impfungen
- Bei den Impfstoffen gilt die Antikörperantwort gegen das Spike-Protein als wichtiger Parameter. Doch anscheinend ist nach einer durchgemachten Corona-Infektion der Anteil der Antikörper gegen das Nukleokapsid-Protein des Virus höher. Warum konzentrieren sich die Impfstoffe dann nicht auf das Nukleokapsid-Protein?
Die Immunantwort bei SARS-CoV-2 richtet sich vor allem gegen die rezeptorbindende Domäne des viralen Spike-Proteins. Der Körper bildet zwar auch Antikörper gegen das Nukleokapsid-Protein, diese schützen allerdings nicht vor der Infektion.
- Wäre es nicht möglich, die Spikes/Rezeptoren zu "verkleben", (z.B. wie beim Tamiflu) damit das Virus sich nicht mehr an eine Zelle haften kann?
Das wäre theoretisch möglich, man bräuchte aber sehr viel Zeit, um so ein Medikament zu produzieren. Diese Methode würde auch nur ganz am Anfang der Infektion oder prophylaktisch wirken, da sonst zu viel Virus für den „Kleber“ im Körper wäre.
- Warum kann man sich nicht vermehrt auf Therapien anstatt Impfungen fokussieren und beispielsweise verstärkt Medikamente mit monoklonalen Antikörpern einsetzen?
Prinzipiell ist gegen Viren Vorbeugung viel besser als Therapie. Es ist jedoch auch möglich, COVID-19 Patient*innen unter bestimmten Voraussetzungen monoklonale Antikörper als Infusion zu verabreichen. Als monoklonale Antikörper werden im Labor entwickelte Proteine bezeichnet, die sich gezielt an Krankheitserreger binden und helfen, diese abzuwehren. Sie werden in der Medizin vielfältig eingesetzt. Die monoklonalen Antikörper in den COVID-19-Medikamenten funktionieren folgendermaßen: Sie binden gezielt an das Spike-Protein von SARS-CoV-2 und verhindern so, dass sich das Virus an eine menschliche Zelle heften kann. Monoklonale Antikörper können in der frühen Krankheitsphase die Viruslast bei leichter bis moderater COVID-19-Erkrankung senken und können auch vorbeugend zur Verhinderung einer Erkrankung mit COVID-19 eingesetzt werden. Hersteller und österreichische Ministerien betonen jedoch, dass COVID-19-Medikamente mit monoklonalen Antikörpern Risikopatientinnen und -patienten vor einer schweren Erkrankung bewahren sollen, jedoch keine Alternative zur Corona-Schutzimpfung sind.
- Wird es langfristig bei der Corona-Schutzimpfung bleiben, oder wird man eher Mittel suchen, die COVID-19 heilen?
Die aktuell verfügbaren Impfstoffe haben sich für die Reduktion der Übertragung und Schwere der Krankheit bewährt, und das trotz der verschiedenen Varianten, die entstanden sind.
Generell ist es besser, viralen Infekten vorzubeugen als diese zu heilen. Sichere und wirksame Medikamente zur Heilung einer vorhandenen Infektion sind schwer herzustellen. Viren können sich auch schnell verändern und dadurch das Mittel wirkungslos machen.
Heterologe Impfung
- Was bedeutet heterologes Impfen?
Unter einem heterologen Impfschema versteht man die Kombination unterschiedlicher Impfstoffe für das vorgesehene Impfschema, d.h. beispielsweise ein Vektorimpfstoff als Erstimpfung und ein mRNA-Impfstoff als zweite Teilimpfung. Manchmal wird eine heterologe Impfung auch als Kreuzimpfung bezeichnet.
- Gibt es Daten zum Mischen von Impfstoffen – d.h. einem Wechsel von mRNA- zu Vektor-Impfstoff nach der ersten Teilimpfung oder umgekehrt?
Ja, mittlerweile gibt es Daten aus Großbritannien und Spanien, wo Probanden die erste Teilimpfung mit dem Vektorimpfstoff Vaxzevria (AstraZeneca) und nach etwa 29 Tagen eine zweite Teilimpfung mit dem mRNA-Impfstoff Comirnaty (BioNTech/Pfizer) erhielten. In der spanischen Studie (CombiVacs) waren die neutralisierenden Titer nach der zweiten Immunisierung signifikant, es waren ausreichend neutralisierende Antikörper vorhanden. Jedoch gab es in dieser Studie keinen direkten Vergleich von einer zweiten Teilimpfung mit Vaxzevira oder Comirnaty ohne Impfstoff-Wechsel. Es wurden auch keine Angaben zur zellulären Immunantwort gemacht, die Aufschluss über die zytotoxischen T-Zellen und die Gedächtniszellen (B-Zellen) gegeben hätten. Wie lange der Impfschutz noch aufrecht bleibt, ist somit ungewiss.
Auch bei inaktivierten Impfstoffen schneiden heterologe Impfungen in Studien besser ab als homologe (immer mit dem gleichen Impfstoff): Wurden inaktivierte Impfstoffe entweder vor oder nach Vektor- oder mRNA-Impfstoffen verabreicht, führte dies zu einer besseren Immunantwort.
In Österreich wird es allerdings nach wie vor als off-label angesehen, wenn man im Lauf der Grundimmunisierung – das sind aktuell 3 Impfungen – den Impfstoff wechselt.
- Kann auch nach zwei Teilimpfungen für die dritte und/ oder vierte Impfung noch der Impfstoff gewechselt werden? Ist das sinnvoll?
Ja, ein Wechsel zu einem anderen Impfstoff kann auch nach der zweiten Teilimpfung noch erfolgen.
So etwa kann nach zweimal mRNA-Impfstoff für die die dritte Impfung auf einen inaktivierten Impfstoff gewechselt werden und umgekehrt. Für den Wechsel auf einen mRNA-Impfstoff nach zweifacher Impfung mit inaktiviertem Impfstoff gibt es bereits Daten: Dieses Impfschema zeigte bessere Wirkung gegen die Omikron-Variante als eine dreifach-Impfung mit inaktiviertem Impfstoff.
Wie schon weiter oben erwähnt, wird es in Österreich allerdings nach wie vor als off-label angesehen, wenn man im Lauf der Grundimmunisierung – das sind aktuell 3 Impfungen – den Impfstoff wechselt: Die Grundimmunisierung soll mit dem gleichen Impfstoff erfolgen, danach gibt es die Empfehlung, mit einem zugelassenen Impfstoff (der Wahl) zu immunisieren.
Impfung für Kinder
- Was ist der aktuelle Stand bei Impfstoffen für Kinder?
Die Impfung ist in Österreich für Kinder ab 5 Jahren zugelassen und wird dreimalig empfohlen. Aktuell ist der Impfstoff Comirnaty (Biontec/Pfizer) für Kinder ab 5 Jahren in Europa zugelassen, Spikevax (Moderna) ab 6 Jahren und, Nuovaxovid (Novavax) ab 12 Jahren. Für Kinder unter 5 Jahren gibt es in Europa noch keine zugelassenen COVID-19-Impfstoffe. In den USA hingegen sind die Impfstoffe von BioNtech/Pfizer und Moderna bereits für die ganz Kleinen ab 6 Monaten zugelassen.
- Gibt es besondere Kriterien/ Besonderheiten im Zulassungssystem bei der Entwicklung von Impfstoffen für Kinder?
Ja, Studien an Kindern dürfen nur nach enger Rücksprache mit den Behörden durchgeführt werden, da sie eine besonders vulnerable Gruppe darstellen. Bevor dies erlaubt ist, müssen Daten zur Sicherheit und Wirksamkeit in Erwachsenen vorliegen. Im Anschluss kann dann schrittweise mit Studien in Kindern begonnen werden, gestartet wird mit den Älteren.
- Gibt es schwere Verläufe von COVID-19 bei Kindern?
Bei Kindern gibt es selten schwere Verläufe von COVID-19, aber es gibt sie. Derzeitige Erkenntnisse deuten darauf hin, dass Kinder mit bestimmten Grunderkrankungen und Säuglinge ( <1 Jahr) ein erhöhtes Risiko für schwere Erkrankungen haben könnten.
Ähnlich wie bei Erwachsenen können Kinder mit schwerer COVID-19 Erkrankung Atemversagen, Myokarditis, Schock, akutes Nierenversagen, Koagulopathie und Systemversagen mehrerer Organe entwickeln. Einige Kinder mit COVID-19 haben andere schwerwiegende Probleme wie Intussuszeption (Einstülpung des Darmes) oder diabetische Ketoazidose (eine durch Insulin-Mangel verursachte, lebensbedrohliche Entgleisung des Stoffwechsels) entwickelt. In seltenen Fällen wurde vom "Multisystem Inflammatory Syndrome in Children (MIS-C)" (eine Entzündung von Organen wie Herz, Lunge, Nieren, Gehirn etc.) berichtet. Erwähnenswert ist, dass die Schwangerschaft an sich einen Risikofaktor darstellt: Schwangere haben ein erhöhtes Risiko für einen schweren Verlauf von COVID-19. Die Impfung ist daher für sie besonders wichtig.
Anpassung von Impfstoffen für Frauen
- Werden bei der Dosierung des Impfstoffes Genderaspekte berücksichtigt?
Nein, derzeit noch nicht. Die Dosierung sowie die Auswertung zur Sicherheit, Immunogenität und Wirksamkeit wird nach Alter gestaffelt.
- Warum kann man nicht auch Frauen in die klinischen Studien einschließen? Es sind ja nicht alle schwanger? Das Argument ist doch oft, dass an Impfungen für Frauen zu wenig geforscht wird. Es wurde auch schon angedeutet, dass die Dosierung der Impfstoffe für Frauen zu hoch sei.
Laut Gesetz ist es – mit wenigen Ausnahmen – verboten, gebärfähige Frauen in klinische Studien einzuschließen, wenn zuvor nicht spezielle präklinische Studien durchgeführt wurden. In den frühen Phasen der klinischen Entwicklung gibt es leider häufig noch zu wenige Daten, ob der Impfstoff toxisch auf Geschlechtsorgane wirkt oder wie der Impfstoff auf schwangere Frauen oder Ungeborene wirken könnte (es könnte eine Teilnehmerin in der Studie schwanger werden). Daher stimmen Behörden einem Einschluss von Frauen im gebärfähigen Alter in den frühen klinischen Phasen selten zu. Ausnahmen sind Medikamente gegen seltene oder lebensbedrohliche Erkrankungen oder Medikamente gegen Krankheiten, die Frauen betreffen und bei denen der Benefit höher als das Risiko ist, wie z.B. HPV-16 induzierte Gebärmutterkarzinome.
Impfung nach erfolgter Covid-Erkrankung
- Aktuell (Stand September 2022) wird in Österreich vom Nationalen Impfgremium ja empfohlen, auch nach erfolgter Covid-Erkrankung viermal impfen zu gehen. Bringt eine Covid-Erkrankung nicht den gleichen Immunschutz wie eine Impfung?
Auch wenn man bereits an COVID-19 erkrankt war, sollte man sich gegen COVID-19 impfen lassen. Eine Impfung, nachdem man sich von einer COVID-19-Infektion erholt hat, bietet zusätzlichen Schutz gegen eine erneute Infektion. Menschen, die bereits COVID-19 hatten und sich nach ihrer Genesung nicht impfen lassen, erkranken mit größerer Wahrscheinlichkeit erneut an daran als diejenigen, die sich nach ihrer Genesung impfen lassen.
- Wann sollte man sich am besten nach einer erfolgten SARS-CoV-2-Infektion impfen lassen?
Eine Impfung sollte frühestens 3 Monate nach Beginn der Symptome erfolgen. Bei symptomlosen Verläufen ist eine Impfung bereits nach dem Ende der Verkehrsbeschränkungen möglich.
Allgemein zu den Impfungen
- Was bedeutet Grundimmunisierung?
Als Grundimmunisierung bezeichnet man das Erreichen einer vollständigen Immunität gegen eine bestimmte Infektionskrankheit durch Impfung. Diese kann zeitlich begrenzt sein. Viele Impfstoffe benötigen für eine Grundimmunisierung zwei Dosen, um einen ausreichend hohen und vor allem stabilen Antikörpertiter zu entwickeln. Welche Dosisstufe und welches Intervall der Dosen einen optimalen Impfschutz bietet, wird in klinischen Studien für den jeweiligen Impfstoff ermittelt.
- Ist die Impfung „halal“ – geeignet für Muslime?
Die Islamische Glaubensgemeinschaft in Österreich (IGGÖ) hat dazu folgendes veröffentlicht: „Sowie die Mehrheit der islamischen Gelehrten weltweit, rät auch unser theologischer Beratungsrat den Muslim*innen seit der Zulassung der Impfstoffe dazu, den Empfehlungen der Gesundheitsexpert*innen zu folgen und sich impfen zu lassen – gilt doch im Islam das Prinzip, Schaden abzuwenden, bevor er auftritt!“, so Ümit Vural, Präsident der IGGÖ. (Quelle: Presseaussendung der IGGÖ, 22.12.2021)
- Wird man durch die Impfung unfruchtbar?
Nein, das ist eine unbegründete Sorge. Es gibt überhaupt keine Hinweise darauf, dass COVID-19-Imfpstoffe Auswirkungen auf die weibliche oder männliche Fruchtbarkeit haben. Bei Kinderwunsch wird die Impfung sogar ausdrücklich empfohlen. Bei geimpften Personen ist die Rate an Frühaborten, also einer Fehlgeburt bis zur 14. Schwangerschaftswoche, sogar tendenziell niedriger als bei ungeimpften Personen (Quelle: MC Magnus et al. Covid-19 Vaccination during Pregnancy and First-Trimester Miscarriage. N Engl J Med 2021. 385(21):2008-2010. doi: 10.1056/NEJMc2114466, zitiert nach COVID-19-Impfungen: Anwendungsempfehlungen des Nationalen Impfgremiums, Version 10.3, 10.08.2022)
- Was unterscheidet die Corona-Impfstoffe von anderen Impfstoffen gegen FSME, Influenza oder Pneumokokken, sodass man vor der Impfung eine Erklärung bezüglich möglicher Nebenwirkungen unterschreiben muss?
Jeder Impfstoff ist ein individuell und auf das Virus zugeschnittener Impfstoff. Die Technologien werden jedoch meist für mehrere Arten von Viren benutzt.
Bei den COVID-19-Impfstoffen musste eine sogenannte Impfaufklärung durchgeführt und die Impftauglichkeit überprüft werden. Das war deshalb der Fall, weil zu Beginn vor allem jene Personen vorgezogen wurden, die gesundheitliche Risiken und dadurch ein höheres Risiko an Komplikationen hatten. Somit waren viele der zu impfenden Personen altersbedingt und/oder wegen Grunderkrankungen beeinträchtigt. Ließ der Allgemeinzustand einer zu impfenden Person Zweifel an einem günstigen Nutzen-/Risikoverhältnis der Impfung aufkommen, konnte durchaus ein vorübergehendes oder dauerhaftes Zurückstellen von der Impfung erwogen werden.
Darüber hinaus durften die Impfungen auch von DI Krankenschwestern oder anderen Ärzt*innen (Turnus, ausländische) und Medizinstudent*innen durchgeführt werden, um die Verimpfung zu beschleunigen. Diese Erklärung diente auch zur Absicherung (laut „Erlass zu den berufsrechtlichen Voraussetzungen zur Durchführung von COVID-19-Schutzimpfungen“ vom 3.12. 2020).
- Warum ebbt eine Grippe-Welle von alleine ab, COVID aber nicht?
Wir wissen noch nicht, warum das so ist. Die bisherigen Daten zu Wellen, die wir kennen, kommen alle vom Influenza-Virus, das die Grippe verursacht. Dort zeigen die Pandemien der letzten 100 Jahre, dass es jedes Mal mindestens zwei Infektions-Wellen gab. Von den Grippe-Wellen wissen wir: Sie ebben ab, wenn die Luft trockener und wärmer wird bzw. die Menschen mehr draußen sind. Auch die Schulferien gelten als Mechanismen für eine reduzierte Übertragung. Viele Menschen haben auch einen gewissen Schutz gegen Grippe. Dieser ist beim Coronavirus nicht vorhanden. Weiters ist das Coronavirus infektiöser und stabiler als das Influenza-Virus. Genaue Daten zu SARS-CoV-2 fehlen aber noch.
Immunität
Dauer des Schutzes durch Antikörper
- Was sind neutralisierende Antikörper?
Unter neutralisierenden Antikörpern versteht man solche Antikörper, die eine Infektion von Zellen verhindern können. Bei SARS-CoV-2 sind das insbesondere solche Antikörper, die an die Stelle des Virus binden, die an eine Körperzelle andocken würde und über die das Virus in die Körperzelle gelangen würde (die Rezeptorbindungsdomäne des Spike-Proteins). Durch die Bindung des Antikörpers an diese Stelle kann eine Infektion verhindert werden.
- Wie lange hält der Schutz durch Antikörper nach der Impfung?
Die Dauer des Impfschutzes wird von Faktoren wie Alter, Impfstofftyp und frühere Exposition beeinflusst. Generell ist es nicht unüblich, dass der Titer nach einer Impfung oder Infektion sinkt und nicht mehr detektierbar ist. Denn neben den Antikörpern gibt die zelluläre Immunantwort einen Aufschluss darüber, ob ein Gedächtnis des Immunsystems aufgebaut wurde und so bei einer Re-Infektion rasch wieder spezifische Antikörper gebildet werden können.
Derzeit gibt es Daten, dass die Titer der neutralisierenden Antikörper nach Grundimmunisierung zumindest für 6 Monate stabil bleiben. Studien haben jedoch gezeigt, dass es vor allem in Personen ab 55 Jahren bereits 4 bis 6 Monate nach der Impfung zu einem Abfall kommen kann. Die Antikörperspiegel sind 12 Monate nach Impfung zwar generell niedriger, steigen aber auf einen deutlich höheren Wert nach einer dritten Dosis.
Ein Abfall vom Antikörpertiter ist generell nicht kritisch, wichtig ist der Schwellenwert, ab dem man von einem Impfschutz ausgehen kann. Der darf nicht unterschritten werden. Jedoch fehlen derzeit noch ausreichende Daten, um sagen zu können, welcher Antikörpertiter mit dem Impfschutz korreliert.
Antikörper-Titer nach Impfung
- Was bedeutet "BAU/ml" als Angabe beim Antikörpertiter?
“BAU“ beschreibt die berechnete Höhe der bindenden Antikörper pro Milliliter Blut (die Einheit BAU steht für "Binding antibody units" und ist ein WHO-Standard). Zugrunde liegt hier eine sogenannte ELISA Methode, die dem Nachweis neutralisierender Antikörper dient. Ab einem Wert von 15 BAU/ml resultiert ein positiver Vorhersagewert für das Vorliegen von neutralisierenden Antikörpern von 99,10 %. 15 BAU sind aber wirklich nur das untere Limit, bieten aber sicher keinen ausreichenden Schutz. Eine französische Forschungsgruppe ermittelte bei fast 9.000 Beschäftigten im Gesundheitswesen, welche Antikörperspiegel nach der COVID-19-Impfung schützend wirkten. Dabei stellte sich heraus, dass Geimpfte erst ab einem Antikörpertiter von >1700 BAU/ml alle Beschäftigte (100%) geschützt waren.
- Welcher Richtwert bei den Antikörpern gilt als vollimmunisiert, gibt es hier Richtwerte hinsichtlich eines "sinnvollen" Titers? Gibt es Unterschiede bei den Impfstoffen, was ein guter Wert bei welchem Impfstoff ist?
Wie hoch der Antikörpertiter sein muss, um von einem Impfschutz auszugehen, ist derzeit noch nicht bekannt. Für andere Impfstoffe wurde ermittelt, dass ein vierfacher Anstieg im Vergleich zu dem Titer vor der Immunisierung für einen Impfschutz ausreicht, derzeit wendet man auch diesen Titer an. Pauschal gibt es leider keinen Richtwert für einen Titer, da die Werte durch die unterschiedlichen Analysemethoden variieren.
- Wieso bilden manchen Personen sogar einige Wochen nach der Impfung keine Antikörper? Kann trotzdem ein Schutz gegeben sein?
Manche Menschen sprechen auf bestimmte Antigene nicht an und erlangen durch die Impfung keinen Schutz, auch nicht nach wiederholter Impfung. Bei SARS-CoV-2 weiß man noch nicht, was für einen sicheren Schutz genau benötigt wird. Aber ohne Antikörper ist ein vollständiger Schutz unwahrscheinlich. In so einem Fall sollte man daher einen anderen Impfstoff ausprobieren. Das gleiche Problem gibt es mit dem Hepatitis B-Virus.
- Von welchen Faktoren hängt es ab, ob jemand viele oder wenige Antikörper durch die jeweilige Impfung bildet?
Es gibt eine Vielzahl von Faktoren, die die Immunantwort auf eine Impfung beeinflussen können: Sogenannte extrinsische Faktoren – wie schon vorher bestehende Immunität, Infektionen, Antibiotika, mikrobielle Flora – und
intrinsische Faktoren – wie Alter, Geschlecht, Gesundheitszustand, Genetik. Aber auch Umweltfaktoren, Verhaltensweisen (Rauchen, Alkohol,...). Ernährungsfaktoren (zB. der BMI) spielen hier eine Rolle. Auch das Alter ist wichtig: Ab ca. 60 Jahren kommt es zu altersbedingten Veränderungen, wodurch das Immunsystem die Fähigkeit verliert, sich ausreichend vor Infektionen oder vor Krebs zu schützen. Ältere Personen sprechen auch typischerweise schlechter auf Impfungen an. Es gibt aber auch immunologische Unterschiede zwischen den Geschlechtern – zum Beispiel weiß man, dass erwachsene Frauen nach Impfungen mehr Antikörper bilden können, aber auch eine höhere Anfälligkeit für Entzündungen oder Autoimmunerkrankungen haben.
- Ist es sinnvoll, nach einer Impfung oder einer Corona-Infektion den Immunstatus durch einen Antikörpertest feststellen zu lassen?
Bedingt. Man sieht mit dem Test, ob man Antikörper hat oder nicht. Hat man keine, dann besteht wahrscheinlich auch kein Schutz. In diesem Fall sollte man – nach einer Corona-Infektion erstmals bzw. nach vorangegangener Impfung erneut – mit einem anderen Impfstoff geimpft werden.
Wenn mit dem Test Antikörper nachgewiesen werden, ist es zur Zeit nicht klar, inwieweit man geschützt ist.
Risiken und Nebenwirkungen von Impfungen
Thrombosen
- Bei welchem Impfstoff treten Thrombosen bzw. daraus resultierende Embolien am häufigsten auf? Und wann – gleich nach der Impfung oder zeitverzögert?
Thrombosen und Thrombozytopenien traten vorwiegend bei den Adenoviren-basierenden Vektorimpfstoffen auf, d.h. Vaxzevria (AstraZeneca) und Jcovden (Janssen). Die Symptome treten innerhalb von drei Wochen nach der Impfung auf.
Impfschäden
- Kann man sich sicher sein, dass nicht Jahre nach der Impfung Autoimmunerkrankungen oder sonstige Impfschäden auftreten?
Großteils ja, die Impfstoffreaktionen treten in der Regel innerhalb der ersten drei Monate auf, falls welche auftreten. Bisher gab es bei den Impfstoffen keine Hinweise, dass sie Autoimmunantworten auslösen könnten.
- Haben die Impfstoffe Auswirkungen auf Ungeborene? Können die Impfstoffe Fehlbildungen/Fehlgeburten hervorrufen?
Die Impfstoffe Comirnaty (BioNTech/Pfizer) und Spikevax (COVID-19 Vaccine Moderna) können während der Schwangerschaft angewandt werden. Es liegen mittlerweile für beide Impfstoffe eine Vielzahl an Daten von Schwangeren, die während des zweiten und dritten Trimesters geimpft wurden, vor. Es wurde kein erhöhtes Risiko für Schwangerschaftskomplikationen festgestellt. Die Datenlage für das erste Trimester ist etwas geringer, es wurde jedoch kein erhöhtes Risiko für Fehlgeburten festgestellt. Auch bei den anderen Impfstoffen gibt es keine Hinweise auf ein erhöhtes Risiko bei Anwendung während der Schwangerschaft. Hier liegen bisher aber nur Daten aus Tierversuchen vor, weitere Studien sind noch in der Durchführung.
COVID-19
Post-COVID-Beschwerden
- Sind ernsthafte Langzeitschäden einer Corona-Infektion bekannt, die länger als ein Jahr bestehen bleiben?
Die Weltgesundheitsorganisation (WHO) erwähnt in diesem Zusammenhang anhaltende Symptome und mögliche Spätfolgen, über die Patientinnen und Patienten nach einer akuten COVID-19-Infektion noch Wochen später berichten (Long COVID). Zu den Symptomen zählen Erschöpfung (= Fatigue-Syndrom), reduzierte körperliche Belastbarkeit in Kombination mit weiterbestehender Kurzatmigkeit, Herzrasen, Schwindel, Geruchs- und/oder Geschmacksverlust, Antriebslosigkeit, anhaltender Durchfall usw. Da es sich bei SARS-CoV-2 um ein Virus handelt, das respiratorische Symptome verursacht und u.a. zu Fibrosen der Lunge (verstärkte Bildung von Bindegewebe zwischen den Lungenbläschen) führen kann, ist derzeit noch nicht abzuschätzen, ob es womöglich in weiterer Folge zu Langzeitschäden kommen kann.
- Können durch eine Impfung gegen SARS-CoV-2 immer noch bestehende Post-COVID-Beschwerden (unter anderem allgemeine Abgeschlagenheit, verminderter Geruchs- und Geschmackssinn oder Augenprobleme nach Konjunktivitis und Keratitis) verschlimmert werden?
Eine Impfung kann diese Beschwerden nicht beeinflussen, diese treten durch die SARS-CoV-2-Infektion auf.
- Was versteht man unter „Long COVID“?
Die WHO definiert Long COVID als eine Krankheit, die Leute mit einer wahrscheinlichen oder nachgewiesenen SARS-CoV-2-Infektion betrifft. Symptome und Effekte von Long COVID treten normalerweise innerhalb von drei Monaten ab dem Beginn von COVID-19 auf, bestehen für mindestens zwei Monate und können durch keine alternative Diagnose erklärt werden. Typische Symptome sind beispielsweise Müdigkeit, Atemnot, kognitive Fehlfunktionen und andere.
- Was passiert mit SARS-CoV-2 im Körper von Long COVID-Patient*innen, weiß man das? Wird das Virus bei ihnen komplett aus dem Körper eliminiert, oder wäre es auch möglich, dass es in ihnen „schlummert“?
Prinzipiell könnte SARS-CoV-2 im Körper verbleiben. Wir benötigen hier jedoch noch mehr Daten zu Langzeitinfektionen, um sagen zu können, wie lange und wo das Virus im Körper verweilen kann, und ob es hier einen Zusammenhang mit Long COVID gibt. Erste Untersuchungen von Long COVID-Patient*innen deutet allerdings darauf hin, dass die meisten von ihnen negativ für SARS-CoV-2 sind. Der Grund für die langanhaltenden Symptome ist teilweise immer noch unklar. Ein Problem dabei ist die große Vielfalt an Symptomen, an denen Long-COVID-Kranke leiden.
Faktoren, die den Krankheitsverlauf bei COVID-19 beeinflussen
- Kann man bereits mit Gewissheit sagen, was die unterschiedlichen Krankheitsverläufe beeinflusst?
Nein, kann man nicht. Wichtige Parameter sind Alter, Geschlecht, Immunstatus, Gewicht (bzw. Übergewicht) sowie Diabetes mellitus Typ 2. Aber warum an sich junge, gesunde Menschen schwere Corona-Verläufe entwickeln, ist noch unklar.
- Spielen Geschlecht oder Hormonkonzentrationen eine Rolle bei COVID?
Welche Kriterien Einfluss auf eine Infektion mit dem Coronavirus und eine Erkrankung haben, ist noch nicht restlos geklärt. Fest steht, dass laut internationalen Studien Männer weltweit ein höheres Risiko haben, eine intensivmedizinische Behandlung zu benötigen oder an COVID-19 zu sterben. Das weibliche Immunsystem scheint besser gegen SARS-CoV-2 gerüstet zu sein. So beginnt die angeborene Immunantwort auf virale Infektionen bei Männern ab etwa 60 Jahren massiv abzufallen, während dieser Rückgang bei Frauen erst etwa sechs Jahre später einsetzt. Auch die Immunabwehr, etwa durch T-Zellen, in der frühen Phase einer Corona-Infektion ist selbst bei älteren Frauen robuster. Das weibliche Sexualhormon Östrogen scheint eine Schutzfunktion zu erfüllen, indem es Rezeptoren unterdrückt, die SARS-CoV-2 nutzt, um in Zellen einzudringen. Zudem enthält das X-Chromosom viele Gene, die die Immunantwort regulieren und insbesondere in der Frühphase der Infektion eine bedeutende Rolle spielen.
Es gibt auch Unterschiede zwischen Männern und Frauen beim angeborenen Immunsystem in der Detektion von fremden Nukleinsäuren, und diese beeinflussen auch die Anfälligkeit für Infektionskrankheiten.
- Wie wirken sich bestehende chronische Entzündungen und Erkrankungen bei COVID-Infektionen aus?
Bei rheumatoider Arthritis (RA), entzündlicher Darmerkrankung (IBD), Psoriasis oder anderen Autoimmunerkrankungen, die eine Entzündung verursachen, werden Medikamente benötigt, die die Überreaktion des Körpers reduzieren sollen. Dies kann die Fähigkeit zur Bekämpfung von Infektionen beeinträchtigen, einschließlich SARS-CoV-2. Es kann auch die Bildung von Antikörpern nach einer Impfung beeinflussen. Klinische Studien mit Teilnehmer*innen mit chronischen Entzündungen oder Erkrankungen haben jedoch gezeigt, dass bei diesen nach der Impfung mit einem mRNA-Impfstoff kein signifikanter Unterschied hinsichtlich der Nebenwirkungen oder der Antikörperbildung besteht.
Patient*innen mit Atemwegs-, Herz-Kreislauf- oder Nierenerkrankungen haben sowohl ein höheres Risiko, aufgrund einer COVID-19-Infektion ins Krankenhaus eingeliefert zu werden, als auch intensivmedizinisch betreut werden zu müssen oder aufgrund einer COVID-19 Infektion zu versterben.
- Sind, wie bei HIV, Menschen mit bestimmten genetischen Voraussetzungen bekannt, die nicht an COVID-19 erkranken können?
Manche Menschen sind aufgrund ihrer genetischen Ausstattung resistent gegen bestimmte Viren. Bei HIV und bestimmten Noroviren sind solche Fälle bekannt. Ob es solche genetischen Varianten auch in Bezug auf COVID-19-Erkrankungen gibt, wird derzeit noch untersucht. Da es immer wieder Fälle von Personen gibt, die trotz engem Kontakt mit Infizierten ohne entsprechenden Schutz nicht erkranken, wird eine solche Resistenz vermutet.
Diverses
- Sollen sich Schwangere impfen lassen?
Ja. Die Corona-Schutzimpfung ist für schwangere Personen ab dem 2. Trimester empfohlen. In der Schwangerschaft besteht bei COVID-19 ein erhöhtes Risiko, eine intensivmedizinische Behandlung und eine invasive Beatmung zu benötigen. Außerdem ist das Risiko einer Frühgeburt erhöht.
Impfungen gegen COVID-19 sollen abhängig von allfälligen Vorimpfungen ab dem 2. Schwangerschaftsdrittel vorgenommen werden, bevorzugt mit dem Impfstoff Comirnaty. Ab einem Alter von 30 Jahren kann jedoch auch Spikevax verwendet werden.
- Wie lange nach einem negativen PCR-Testergebnis kann man davon ausgehen, niemand anderen infizieren zu können?
48 Stunden, wahrscheinlich 72 Stunden. Omikron hat eine Inkubationszeit von rund 3 Tagen, wobei die Bandbreite hier null bis acht Tage beträgt und man somit auch schon früher ansteckend sein kann.
- Stimmt es, dass SARS-CoV-2 die Wirtszelle (Lunge, Rachen etc.) nicht zerstört?
Das stimmt. Die Zellen werden vom Immunsystem als infiziert erkannt und vom eigenen Körper zerstört.
- Ist es möglich, gleichzeitig Corona und die Grippe zu bekommen, oder – etwas wissenschaftlicher gefragt: Können Coronaviren und Grippeviren gleichzeitig den gleichen Wirt befallen oder schließen sie sich gegenseitig aus?
Derzeit gibt es Hinweise darauf, dass, wenn ein Virus den respiratorischen Trakt befällt, ein anderes nicht so effektiv ist. So etwa kommt es beim Auftreten einer Grippe-Epidemie zu weniger Erkältungen (grippalen Infekten). Seit dem Auftreten der SARS-CoV-2-Pandemie sind Infektionen des Atmungstrakts durch beinahe alle anderen Pathogene gesunken. Eine Ausnahme bildet hier nur das Erkältungsvirus, das Schnupfen verursacht. Dieses vermehrt sich vor allem in der Nase und nicht wie SARS-CoV-2 im Hals und in der Lunge.
- Die vergangenen Winter standen ganz im Zeichen des Coronavirus. Wie hat SARS-CoV-2 die Grippesaison beeinflusst?
In den letzten Jahren gab es keine wirkliche Grippesaison, da die Maßnahmen gegen SARS-CoV-2 auch die Übertragung des Influenzavirus verhindern.
- Es wird an einem Nasenspray gearbeitet, der das Andocken des Corona-Virus verhindern soll. Wäre ein solcher Zugang eine Möglichkeit für die Zukunft?
Das wäre es, würde aber nur prophylaktisch oder am Anfang wirken. Es ist immer besser, virale Infektionen mit Impfstoffen vorzubeugen als zu versuchen, mit Wirkstoffen die Infektion zu reduzieren, vor allem wenn es so viele asymptomatische Infektionen gibt.
- Wie schwer verläuft die Infektion von SARS-CoV-2 bei Fledermäusen?
Meistens asymptomatisch, das Virus hat sich an dieses Tier angepasst.
- Warum ist das Virus nicht aus einem biotechnologischen Labor ausgekommen? Was hält man jemandem entgegen, der diese Meinung vertritt?
Es gibt viele Argumente, die gegen einen Ausbruch aus einem Labor sprechen. Vier der wichtigsten sind: 1) Die Unterschiede (ca 1200 Basen) von SARS-CoV-2 und den nähesten bekannten Viren sind sehr hoch, d.h. man hat ein Virus wie SARS-CoV-2 noch nie gesehen. 2) Man sieht keine Eigenschaften, die durch eine Manipulation entstanden wären. 3) Coronaviren sind Rekombinationskünstler, und es gibt so viele Varianten der Coronaviren in diversen Tieren, dass die Entstehung in der Natur plausibel wäre. 4) Auch SARS-CoV-1 ist im Jahr 2003 auf natürliche Weise entstanden, wir wissen aber noch immer nicht wo.
- Welche Wirkung hat UV-Licht auf die Infektionshäufigkeit?
UV-Licht reduziert die Infektiosität von jedem Virus, da sein Erbmaterial dadurch beschädigt wird. Das ist wahrscheinlich ein Grund, warum im Sommer in Europa die Fälle sinken.
- Werden wir SARS-CoV-2 vollständig ausrotten können?
Ganz sicher nicht in den nächsten zehn Jahren. Statistiker gehen davon aus, dass ein Pandemiezyklus 70 Jahre dauert.
Ein großes Dankeschön an Christina Nicolodi und Tim Skern für die Unterstützung bei der Beantwortung der vielen Fragen!
as, 21.09.2022
Downloads: