Newsletter
Hier finden Sie Anregungen und Materialien für die Vermittlung lebenswissenschaftlicher Themen im Unterricht. Von A wie Allergie bis Z wie Zelle.
Die chemische Ampel – Ein Beispiel für lernen durch „Mysteries“
Laborarbeit kann richtig schön sein und sie steckt voller überraschender und unerwarteter Beobachtungen, mit denen sich der Forscherdrang der SchülerInnen wecken lässt. Naturwissenschaftliche Phänomene eignen sich deshalb besonders gut für das Unterrichtskonzept, durch „Mysteries“ forschend zu lernen. Dabei werden die SchülerInnen mit einem unerwarteten Phänomen konfrontiert, das ihre Aufmerksamkeit weckt, Fragen aufwirft und sie dazu motiviert mehr zu den Hintergründen erfahren zu wollen.
Passend zum Thema pH-Indikatoren und Redoxreaktionen bietet sich beispielsweise das Experiment der chemischen Ampel an, das mit wenigen Zutaten umsetzbar ist.
Benötigte Materialien
- Messzylinder (2x 100 mL)
- Behälter, z.B. Schott-Laborflasche (2x 250 mL)
- Indigokarmin (20 mg)
- destilliertes Wasser / dH2O (2x 100 mL)
- NaOH-Plätzchen (5g)
- Glukose (3g)
Video Chemische Ampel - Part 1 (Mysterie): https://www.instagram.com/reel/CgCCuCOMZf0/
Video Chemische Ampel - Part 2 (Auflösung): https://www.instagram.com/reel/Cl8qv0EuaPR/
Herstellung der Lösung Chemische Ampel
- Lösung A (farblos): Lösen Sie 3 g Glukose und 5 g NaOH-Plätzchen in 100 ml dH2O in einer Schott-Flasche. Eventuell wird für eine verbesserte Löslichkeit ein Magnetrührer benötigt.
- Lösung B (blau): Lösen Sie 20 mg Indigokarmin in 100 ml dH2O in einer Schott-Laborflasche.
- Lösung B wird in Lösung A gegeben. (Verschließen Sie die Schott-Laborflasche.)
Voraussetzung:
Die SchülerInnen sollten das Prinzip von pH-Indikatoren kennen und mit den Grundlagen von Redoxreaktionen vertraut sein.
Ablauf
- Demonstrieren Sie den Farbumschlag indem Sie den SchülerInnen unser Instagram Video „Chemische Ampel - Part 1“ zeigen.
- Fragen Sie nach möglichen Erklärungen, welche chemischen Vorgänge zu den Farbumschlägen führen können. Durch gezieltes Fragen kann man die SchülerInnen an die richtige Lösung heranführen.
- Stellen Sie gemeinsam mit den SchülerInnen die Lösung laut obiger Anleitung und mit Hilfe des Videos „Chemische Ampel - Part 2" her und testen Sie ihre eigene Lösung.
Erklärung – Was passiert?
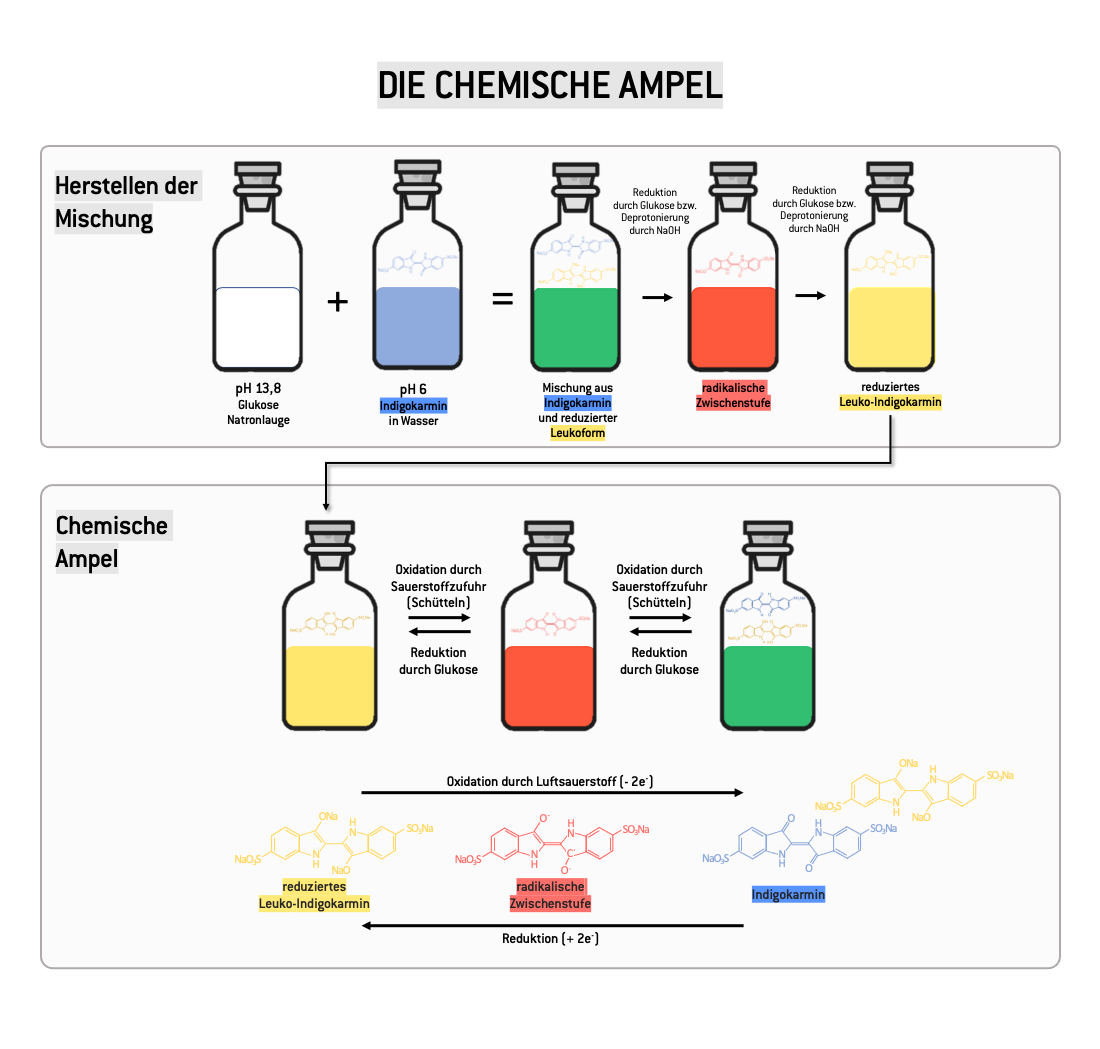
Indigokarmin ist ein pH-Indikator, der abhängig vom pH-Wert entweder gelb (bei pH>13) oder blau (bei pH<11,5) ist. Löst man den Farbstoff in Wasser (pH~6) ist er blau.
Gießt man bei der Herstellung der chemischen Ampel die blaue, wässrige Indigokarmin-Lösung in die mit Glukose versetzte, farblose Natronlauge (pH~13,8), wird das Indigokarmin deprotoniert und färbt sich daher gelb. Dazwischen liegt eine Mischung aus gelbem (bereits deprotoniertem) und blauem (noch protoniertem) Farbstoff vor, die Lösung erscheint daher für unser Auge kurzfristig grün, bevor sie eine gelbe Färbung einnimmt.
Zusätzlich verändert Indigokarmin nicht nur abhängig vom pH-Wert die Farbe, sondern auch wenn es - wie in unserem Fall durch Zugabe von Glukose - reduziert wird. Die reduzierte Form ist ebenfalls gelb, der Farbwechsel von blau zu gelb läuft in diesem Fall aber über eine rote Zwischenstufe ab.
Durch das Schütteln gelangt Luftsauerstoff in die Lösung, dabei wird das Indigokarmin von gelb über die rote Zwischenstufe zu blau oxidiert. Um den blauen Zustand zu erreichen, muss man lange genug schütteln, damit ausreichend Sauerstoff zugeführt wird. Aber selbst dann sind nicht alle Indigokarminmoleküle in unserer Lösung oxidiert. Die Mischung aus gelben (reduzierten) und blauen (oxidierten) Farbstoffmolekülen erscheint für unsere Augen grün.
Lässt man die Lösung stehen, entweicht der Sauerstoff aus der Lösung langsam und die Mischung wird (erneut über eine rote Zwischenstufe) wieder gelb.
Die Darstellung oben gibt einen genaueren Überblick über die chemischen Abläufe.
ACHTUNG: In diesem Experiment wird mit dem Gefahrenstoff Natriumhydroxid gearbeitet. Nachmachen nur im Labor und mit erwachsener Betreuung mit entsprechender Fachkenntnis. Zur Entsorgung die Lösung neutralisieren und in den Abguss leeren oder einer Säuren-Basen-Sammlung zuführen.
Mehr zum Thema Lernen mit Myteries können Sie im TEMI Guidebook "Unterrichten nach TEMI - Wie die Verwendung von Mysteries das Lernen in den Naturwissenschaften unterstützen kann" nachlesen.
sa, 09.12.2022